Содержание
что это такое, где плюс и где минус на диоде
Классические термины из физики и химии часто встречаются в инструкциях к использованию современных приборов. Необходимо точно знать, что такое определение под собой подразумевает и как его применять к тем или иным конструкциям и явлениям.
Содержание
- Что такое анод и катод
- Анод
- Катод
- Как определить анод и катод
- Сфера применения
- Электрохимия
- Гальванотехника
- Вакуумные и полупроводниковые электроприборы
Что такое анод и катод
Потребитель сталкивается с понятиями анод и катод при зарядке и разрядке аккумулятора, зарядке и обслуживании батареи.
Понять разницу между катодом, анодом, положительным и отрицательным зарядом проще всего, вспомнив некоторые положения из электрохимии.
- Гальванические элементы – электрический ток производится благодаря текущей химической реакции. Именно на этом принципе работают батарейки и аккумуляторы.
 Поэтому их называют химическими источниками тока.
Поэтому их называют химическими источниками тока. - Электролиз – химическая реакция, которая протекает за счет включения в систему источника электроэнергии.
В обоих случаях один из электродов несет более высокий потенциал. Этот электрод считается положительным. Электрод с более низким потенциалом и необязательно отрицательным, будет носить название отрицательный. Ток, соответственно, течет от носителя более высокого потенциала к носителю более низкого потенциала.
Да, часто
50%
Очень редко
28.57%
Не припоминаю
21.43%
Проголосовало: 56
Анод
По определению анодом выступает электрод, на котором протекает окислительная реакция. Это означает, что электрод служит источником электронов. В химии его же нередко именуют восстановителем.
Катод
Под катодом подразумевают электрод, на котором протекает реакция восстановления. Здесь электрод забирает электроны и называется окислителем.
Принимая, что ток является движением положительно заряженных частиц, а не отрицательных, получается, что ток в растворе идет от катода к аноду. В цепи, соединяющей элементы гальванической пары, электроны идут от минуса к плюсу и с этой точки зрения катод является плюсом, а анод – минусом.
Противоречие кажущееся, ведь направление тока определяется движением положительных частиц, хотя фактически в металлической цепи его обеспечивает движение электронов.
Как определить анод и катод
Если с батарейкой все довольно просто (полюс и минус не меняются местами), то с зарядкой аккумулятора дело обстоит сложнее.
Во время зарядки разность между большим и меньшим потенциалом увеличивается, то есть потенциал положительного электрода становится выше, чем его же потенциал в покое – накапливается заряд, а потенциал отрицательного электрода становится меньше, чем он же в состоянии покоя. Отсюда вытекает, что положительный электрод выступает анодом, а отрицательный – катодом.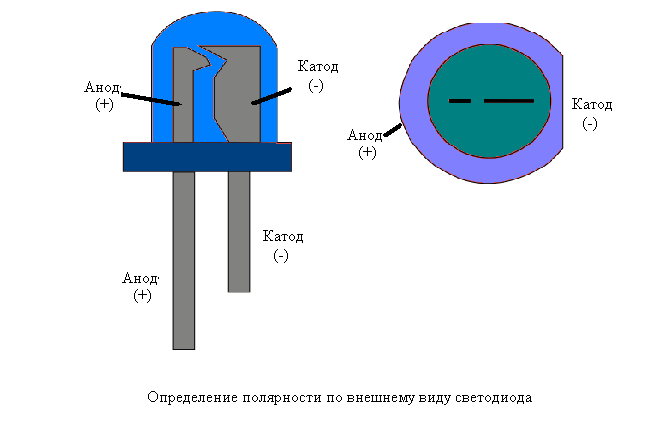
При использовании устройства потенциал положительного электрода (анода) всегда остается больше, чем потенциал отрицательного (катода). Но во время цикла разрядки/зарядки роль электрода меняется: при разрядке положительным становится катод, отрицательным – анод. Во время зарядки положительным выступает анод, отрицательным – катод.
Если речь идет о растворах и электрофизических реакциях в них, проще запомнить, что катионы – всегда частицы с положительным зарядом, а значит двигаются к минусу. Анионы – частицы всегда с отрицательным зарядом и двигаются к плюсу.
Валера
Голос строительного гуру
Задать вопрос
Чтобы запомнить, где плюс, где минус, используют мнемоническое правило. В словах «катод» и «минус», а также в словах «анод» и «плюс» одинаковое количество букв. В нормальном режиме работы любого электрического прибора ток вытекает из катода и втекает в анод. Даже если речь о металлической жиле, поскольку здесь направление тока определяют не смещении электронов, а смещение дырок.
Сфера применения
В промышленности используют не только собственно гальванические элементы (для получения электрического тока), но и электрохимические реакции, которые протекают под действием тока. Самый известный – получение тонкопослойного защитного покрытия стали – из цинка, алюминия, цинкового-алюминиевых сплавов.
Электрохимия
Электролиз по своему значению противоположен работе гальванического элемента: реакция проходит под действием тока. При этом плюс источника питания все же именуется катодом, а минус анодом, что как бы противоречит вышесказанному. Происходит это потому, что ток от плюсового вывода источника питания уходит на плюсовой вывод аккумулятора и в этом случае последний уже никак не может быть катодом. В результате электроды аккумулятора при зарядке меняются местами, потому что реакция идет в обратном направлении.
Гальванотехника
Посеребрение, золочение, хромирование, оцинковка – наиболее известные способы использования процесса осаждения вещества.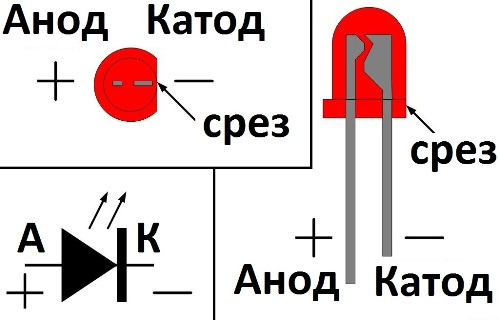 Принцип действия таких установок одинаков: изделие погружают в электролитическую ванную, в которой оно выступает катодом. На его поверхности осаждаются ионы металла – катионы. Чтобы изделие стало катодом, к нему подключают плюсовой вывод источника питания.
Принцип действия таких установок одинаков: изделие погружают в электролитическую ванную, в которой оно выступает катодом. На его поверхности осаждаются ионы металла – катионы. Чтобы изделие стало катодом, к нему подключают плюсовой вывод источника питания.
Вакуумные и полупроводниковые электроприборы
Понятие катода и анода, а точнее плюса и минуса в вакуумных и полупроводниковых приборах связано с возможностью протекания тока только в одном направлении или в двух. Полупроводник допускает только прямое течение тока, а при наложении напряжения обратного типа ток здесь течет, но крайне незначительно. Для резистора же вопрос не принципиален: он пропускает ток в обоих направлениях.
Катодом и анодом называют выводы диода – ножки. К плюсу батареи подключается анод. Называется он так, потому что у диода в ток любом случае втекает в анод. Светодиод и даже вакуумный подключается точно так же: анод к плюсу, а катод к минусу.
У пассивных потребителей катод и анод (плюс и минус) не меняются.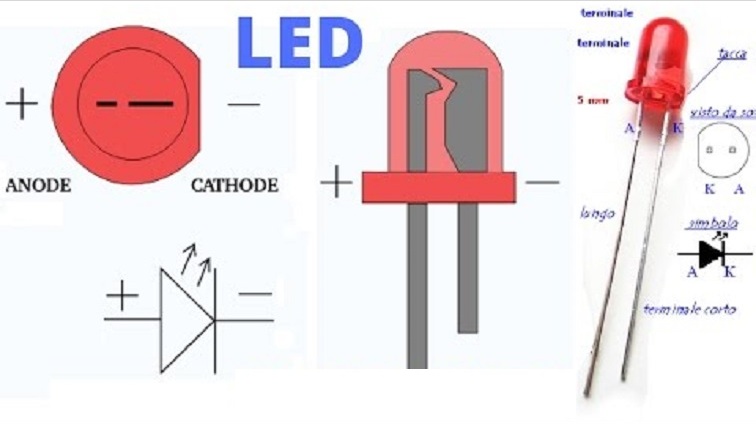 У активных, способных пропускать ток в обоих направлениях, разряжаться и заряжаться – плюсы и минус могут меняться. В аккумуляторе катод положительный во время разрядки и отрицательный при зарядке. Для правильного использования приборов и элементов важно помнить одно: у всех потребителей энергии – электронных деталей, электролизеров, гальванических батарей − вывод, подключаемый к плюсу, называется анодом.
У активных, способных пропускать ток в обоих направлениях, разряжаться и заряжаться – плюсы и минус могут меняться. В аккумуляторе катод положительный во время разрядки и отрицательный при зарядке. Для правильного использования приборов и элементов важно помнить одно: у всех потребителей энергии – электронных деталей, электролизеров, гальванических батарей − вывод, подключаемый к плюсу, называется анодом.
Что такое анод и катод — простое объяснение
Среди терминов в электрике встречаются такие понятия как анод и катод. Это касается источников питания, гальваники, химии и физики. Термин встречается также в вакуумной и полупроводниковой электронике. Им обозначают выводы или контакты устройств и каким электрическим знаком они обладают.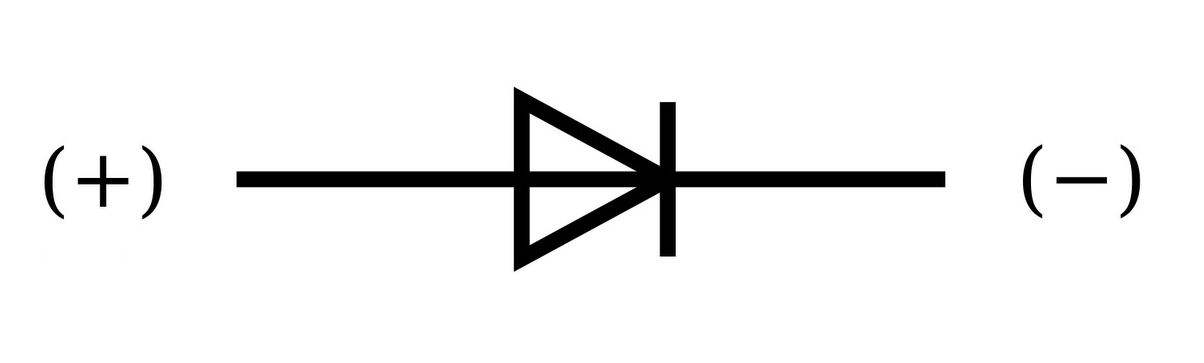 В этой статье мы расскажем, что это такое анод и катод, а также как определить где они находятся в электролизере, диоде и у батарейки, что из них плюс, а что минус.
В этой статье мы расскажем, что это такое анод и катод, а также как определить где они находятся в электролизере, диоде и у батарейки, что из них плюс, а что минус.
- Электрохимия и гальваника
- Процесс электролиза или зарядки аккумулятора
- Гальванотехника
- В электронике
- Заключение
Электрохимия и гальваника
В электрохимии есть два основных раздела:
- Гальванические элементы – производство электричества за счет химической реакции. К таким элементам относятся батарейки и аккумуляторы. Их часто называют химическими источниками тока.
- Электролиз – воздействие на химическую реакцию электроэнергией, простыми словами – с помощью источника питания запускается какая-то реакция.
Рассмотрим окислительно-восстановительную реакцию в гальваническом элементе, тогда какие процессы протекают на его электродах?
- Анод – электрод на котором наблюдается окислительная реакция, то есть он отдаёт электроны.
 Электрод, на котором происходит окислительная реакция – называется восстановителем.
Электрод, на котором происходит окислительная реакция – называется восстановителем. - Катод – электрод на котором протекает восстановительная реакция, то есть он принимает электроны. Электрод, на котором происходит восстановительная реакция – называется окислителем.
Отсюда возникает вопрос – где плюс, а где минус у батарейки? Исходя из определения, у гальванического элемента анод отдаёт электроны.
Важно! В ГОСТ 15596-82 дано официальное определение названий выводов химических источников тока, если кратко, то плюс на катоде, а минус на аноде.
В данном случае рассматривается протекание электрического тока по проводнику внешней цепи от окислителя (катода) к восстановителю (аноду). Так как электроны в цепи текут от минуса к плюсу, а электрический ток наоборот, тогда катод – это плюс, а анод – это минус.
Внимание: ток всегда втекает в анод!
Или то же самое на схеме:
Процесс электролиза или зарядки аккумулятора
Эти процессы похожи и обратны гальваническому элементу, поскольку здесь не энергия поступает за счет химической реакции, а наоборот – химическая реакция происходит за счет внешнего источника электричества.
В этом случае плюс источника питания всё также называется катодом, а минус анодом. Зато контакты заряжаемого гальванического элемента или электроды электролизера уже будут носить противоположные названия, давайте разберемся почему!
Важно! При разряде гальванического элемента анод – минус, катод – плюс, при зарядке наоборот.
Так как ток от плюсового вывода источника питания поступает на плюсовой вывод аккумулятора – последний уже не может быть катодом. Ссылаясь на вышесказанное можно сделать вывод, что в этом случае электроды аккумулятора при зарядке условно меняются местами.
Тогда через электрод заряжаемого гальванического элемента, в который втекает электрический ток, называют анодом. Получается, что при зарядке у аккумулятора плюс становится анодом, а минус катодом.
Гальванотехника
Процессы осаждения металлов в результате химической реакции под воздействием электрического тока (при электролизе) называют гальванотехникой. Таким образом мир получил посеребренные, золоченные, хромированные или покрытые другими металлами украшения и детали. Этот процесс используют как в декоративных, так и в прикладных целях – для улучшения стойкости к коррозии различных узлов и агрегатов механизмов.
Этот процесс используют как в декоративных, так и в прикладных целях – для улучшения стойкости к коррозии различных узлов и агрегатов механизмов.
Принцип действия установок для нанесения гальванического покрытия лежит в использовании растворов солей элементов, которыми будут покрывать деталь, в качестве электролита.
В гальванике анод также является электродом, к которому подключаются плюсовой вывод источника питания, соответственно катод в этом случае – это минус. При этом металл осаждается (восстанавливается) на минусовом электроде (реакция восстановления). То есть если вы хотите сделать позолоченное кольцо своими руками – подключите к нему минусовой вывод блока питания и поместите в ёмкость с соответствующим раствором.
В электронике
Электроды или ножки полупроводниковых и вакуумных электронных приборов тоже часто называют анодом и катодом. Рассмотрим условное графическое обозначение полупроводникового диода на схеме:
Как мы видим, анод у диода подключается к плюсу батареи.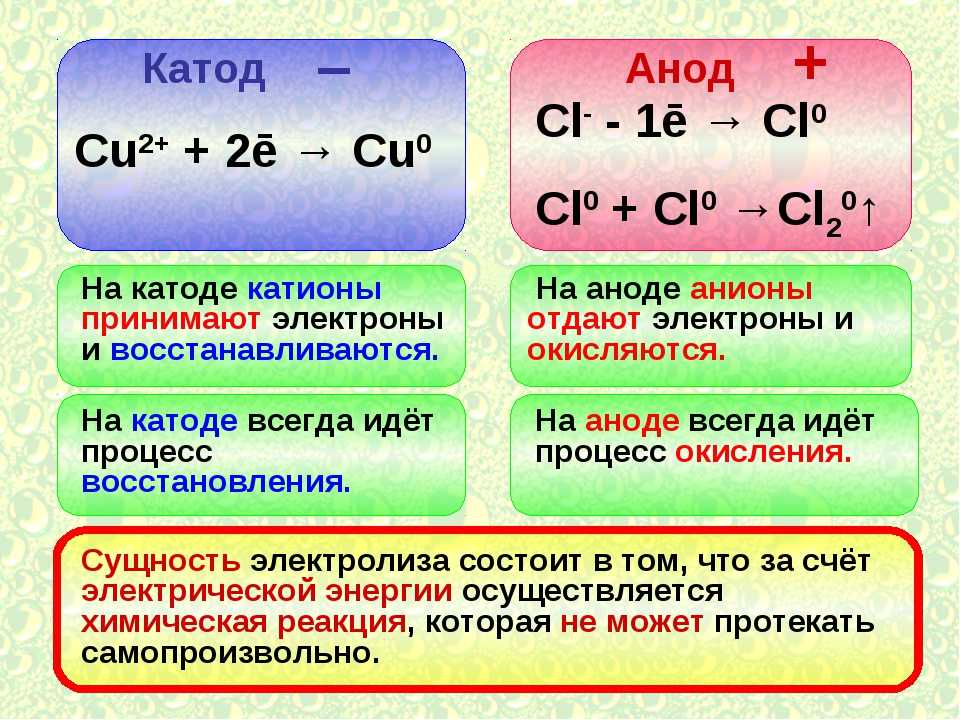 Он так называется по той же причине – в этот вывод у диода в любом случае втекает ток. На реальном элементе на катоде есть маркировка в виде полосы или точки.
Он так называется по той же причине – в этот вывод у диода в любом случае втекает ток. На реальном элементе на катоде есть маркировка в виде полосы или точки.
У светодиода аналогично. На 5 мм светодиодах внутренности видны через колбу. Та половина, что больше — это катод.
Также обстоит ситуация и с тиристором, назначение выводов и «однополярное» применение этих трёхногих компонентов делают его управляемым диодом:
У вакуумного диода анод тоже подключается к плюсу, а катод к минусу, что изображено на схеме ниже. Хотя при приложении обратного напряжения – названия этих элементов не изменятся, несмотря на протекание электрического тока в обратном направлении, пусть и незначительного.
С пассивными элементами, такими как конденсаторы и резисторы дело обстоит иначе. У резистора не выделяют отдельно катод и анод, ток в нём может протекать в любом направлении. Вы можете дать любые названия его выводам, в зависимости от ситуации и рассматриваемой схемы.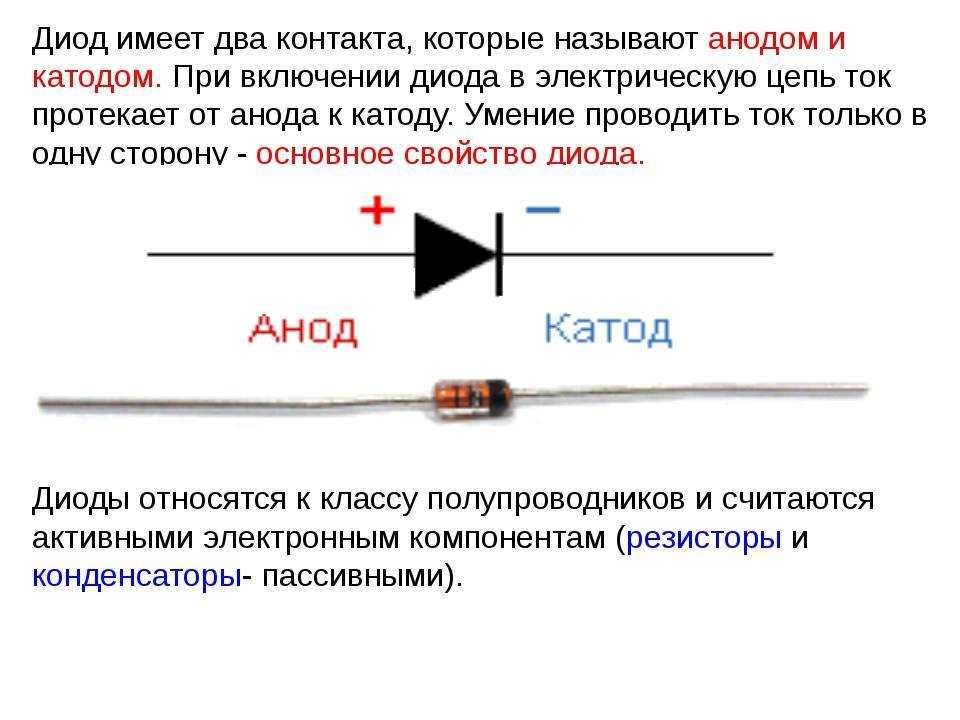 У обычных неполярных конденсаторов также. Реже такое разделение по названиям контактов наблюдается в электролитических конденсаторах.
У обычных неполярных конденсаторов также. Реже такое разделение по названиям контактов наблюдается в электролитических конденсаторах.
Заключение
Итак, подведем итоги, ответив на вопрос: как запомнить где плюс, где минус у катода с анодом? Есть удобное мнемоническое правило для электролиза, заряда аккумуляторов, гальваники и полупроводниковых приборов. У этих слов с аналогичными названиями одинаковое количество букв, что проиллюстрировано ниже:
Во всех перечисленных случаях ток вытекает из катода, а втекает в анод.
Пусть вас не собьёт с толку путаница: «почему у аккумулятора катод положительный, а когда его заряжают – он становится отрицательным?». Помните у всех элементов электроники, а также электролизеров и в гальванике – в общем у всех потребителей энергии анодом называют вывод, подключаемый к плюсу. На этом отличия заканчиваются, теперь вам проще разобраться что плюс, что минус между выводами элементов и устройств.
Напоследок рекомендуем просмотреть полезное видео по теме статьи:
youtube.com/embed/PckDwQmwplg» allowfullscreen=»allowfullscreen»/>
Теперь вы знаете, что такое анод и катод, а также как запомнить их достаточно быстро. Надеемся, предоставленная информация была для вас полезной и интересной!
Материалы по теме:
- Чем отличается переменный ток от постоянного
- Фазное и линейное напряжение в сети
- Как зарядить батарейку в домашних условиях
Опубликовано 24.10.2018 Обновлено 24.10.2018 Пользователем Александр (администратор)
Анод против Катода: в чем разница?
Тема
15 минут чтения
Последнее обновление: 3 апреля 2023 г.
Аноды, катоды, положительные и отрицательные электроды: определение терминов
Значительные разработки были сделаны в области перезаряжаемых батарей (иногда называемых вторичными элементами), и большую часть этой работы можно отнести к разработке электромобилей . Эта работа помогла в 2019 г.Нобелевская премия по химии присуждается за разработку литий-ионных аккумуляторов. Следовательно, термины «анод», «катод», «положительный» и «отрицательный» получили все большее распространение.
Эта работа помогла в 2019 г.Нобелевская премия по химии присуждается за разработку литий-ионных аккумуляторов. Следовательно, термины «анод», «катод», «положительный» и «отрицательный» получили все большее распространение.
В статьях о новых аккумуляторных электродах часто используются названия анод и катод без указания, разряжается аккумулятор или заряжается. Термины анод, катод, положительный и отрицательный не являются синонимами, иногда их можно перепутать, что может привести к ошибкам.
Цель этой статьи — прояснить и четко определить эти различные термины.
- Анод – это электрод, на котором происходит реакция окисления (потеря электронов для электроактивных частиц).
- Катод — это электрод, на котором происходит реакция восстановления (приобретение электронов для электроактивных частиц).
- В батарее на одном и том же электроде могут происходить обе реакции, независимо от того, разряжается батарея или заряжается.

- При наименовании электродов лучше ссылаться на положительный электрод и отрицательный электрод.
- Положительный электрод — это электрод с более высоким потенциалом, чем отрицательный электрод.
- Во время разряда положительный электрод является катодом, а отрицательный электрод — анодом.
- Во время зарядки положительный электрод является анодом, а отрицательный электрод — катодом.
Реакции окисления и восстановления
- Реакция окисления — это электрохимическая реакция, в результате которой образуются электроны. Электрохимическая реакция, происходящая на отрицательном полюсе цинкового электрода никель-цинковой батареи при разряде: 9- \to LiCoO_2}$
– реакция восстановления. Редукция — это приобретение электронов.
Анод, катод
- Анод – это электрод, на котором протекает реакция окисления. Потенциал анода, через который протекает ток, выше его равновесного потенциала: $E_\text a(I)>E_{I=0}$ (рис.
 1).
1).
- Катод – это электрод, на котором протекает реакция восстановления. Потенциал катода, через который протекает ток, ниже его равновесного потенциала: $E_\text c(I)
08 Положительный и отрицательный электроды
Два электроды батарейки или аккумулятора имеют разные потенциалы. Электрод с более высоким потенциалом называется положительным, электрод с более низким потенциалом — отрицательным. Электродвижущая сила, ЭДС в В, батареи представляет собой разницу между потенциалами положительного и отрицательного электродов, когда батарея не работает. 9-$ → отрицательный электрод является анодом.
- Анод – это электрод, на котором протекает реакция окисления. Потенциал анода, через который протекает ток, выше его равновесного потенциала: $E_\text a(I)>E_{I=0}$ (рис.
Рисунок 2: Разрядка и зарядка аккумулятора: слева изменение потенциала положительного и отрицательного электродов; справа, изменение напряжения аккумулятора
Зарядка аккумулятора
Во время заряда аккумулятора напряжение элемента U , разница между положительным и отрицательным, увеличивается (рис. +$ → положительный электрод является анодом. 9-$ → отрицательный электрод является катодом.
+$ → положительный электрод является анодом. 9-$ → отрицательный электрод является катодом.
Заключение
При нормальном использовании аккумуляторной батареи потенциал положительного электрода как при разрядке, так и при перезарядке остается выше, чем потенциал отрицательного электрода. С другой стороны, роль каждого электрода меняется во время цикла разрядки/зарядки.
- Во время разряда положительным является катод, отрицательным — анод.
- Во время заряда положительный является анодом, отрицательный — катодом.
Тексты, описывающие аноды или катоды аккумуляторов, безусловно, имплицитно рассматривают случай разряда. Давайте без колебаний напишем, перефразируя Резерфорда, имплицитное есть не что иное, как плохое явное.
Узнайте больше о потенциостатах и амплификаторах аккумуляторов
Чтобы узнать больше о потенциостатах BioLogic, которые используются в исследованиях аккумуляторов и тестировании аккумуляторов, а также в других областях, представляющих интерес, перейдите на нашу страницу обзора потенциостатов и страницу обзора тестирования аккумуляторов/циклов аккумуляторов.
Узнайте больше о кривых цикла работы батареи
Может быть интересна следующая статья «Как читать кривые цикла работы батареи»
батарея
анод
катод
положительный
отрицательный электрод
Дальнейшее чтение…
-
chevron_right
Сопутствующие товары
-
chevron_right
Циркулятор аккумуляторов серии BCS-800
Серия BCS-800 представляет собой модульную систему циклирования аккумуляторов, предназначенную для удовлетворения потребностей каждого уровня производственно-сбытовой цепочки аккумуляторов, от исследований и разработок до пилотного производства, от производственных испытаний до контроля качества. Состоящие из трех основных продуктов (BCS-805, 810 и 815), эти передовые аккумуляторные циклеры предлагают 8 независимых каналов с максимальным током ±150 мА, ±1,5 А и ±15 А соответственно на канал.
Состоящие из трех основных продуктов (BCS-805, 810 и 815), эти передовые аккумуляторные циклеры предлагают 8 независимых каналов с максимальным током ±150 мА, ±1,5 А и ±15 А соответственно на канал.
физическая химия – положительный или отрицательный анод/катод в электролитическом/гальваническом элементе
спросил
Изменено
2 года, 10 месяцев назад
Просмотрено
584 тыс. раз
$\begingroup$
В гальваническом элементе анод считается отрицательным, а катод считается положительным. Это кажется разумным, поскольку анод является источником электронов, а катод — местом, куда текут электроны.
Однако в электролитической ячейке анод считается положительным, а катод теперь отрицательным. Однако реакция все еще аналогична, в результате чего электроны от анода текут к положительной клемме батареи, а электроны от батареи текут к катоду.
Однако реакция все еще аналогична, в результате чего электроны от анода текут к положительной клемме батареи, а электроны от батареи текут к катоду.
Так почему знак катода и анода меняется при рассмотрении электролизера?
- физико-химия
- электрохимия
$\endgroup$
$\begingroup$
Анод – это электрод, на котором протекает реакция окисления
\begin{align}
\ce{Красный -> Бык + e-}
\end{align}
имеет место, когда катод является электродом, на котором протекает реакция восстановления
\begin{align}
\ce{Бык + e- -> Красный}
\end{align}
. Вот как определяются катод и анод.
Гальванический элемент
Так вот, в гальваническом элементе реакция протекает без помощи внешнего потенциала. Поскольку на аноде идет реакция окисления, в результате которой образуются электроны, в ходе реакции накапливается отрицательный заряд до тех пор, пока не будет достигнуто электрохимическое равновесие. Таким образом, анод отрицательный.
Таким образом, анод отрицательный.
На катоде, с другой стороны, происходит реакция восстановления, которая потребляет электроны (оставляя положительные (металлические) ионы на электроде) и, таким образом, приводит к накоплению положительного заряда в ходе реакции до электрохимического достигается равновесие. Таким образом, катод положительный.
Электролитическая ячейка
В электролитической ячейке вы прикладываете внешний потенциал, чтобы заставить реакцию идти в противоположном направлении. Теперь рассуждения обратные. На отрицательном электроде, где вы создали высокий электронный потенциал с помощью внешнего источника напряжения, электроны «выталкиваются» из электрода, тем самым уменьшая окисленные частицы $\ce{Ox}$, поскольку уровень энергии электронов внутри электрода (Ферми уровень) выше энергетического уровня НСМО $\ce{Ox}$, и электроны могут понизить свою энергию, занимая эту орбиталь — у вас, так сказать, очень реактивные электроны. Таким образом, отрицательный электрод будет тем, где будет происходить реакция восстановления, и, следовательно, это будет катод.
На положительном электроде, где вы создали низкий электронный потенциал с помощью внешнего источника напряжения, электроны «всасываются» в электрод, оставляя после себя восстановленные частицы $\ce{Red}$, потому что уровень энергии электронов внутри электрода (Ферми Уровень) ниже энергетического уровня ВЗМО $\ce{Red}$. Таким образом, положительный электрод будет тем, где будет происходить реакция окисления, и, следовательно, это анод.
Сказка об электронах и водопадах
Поскольку существует некоторая путаница в отношении принципов, на которых работает электролиз, я попытаюсь объяснить это с помощью метафоры. Электроны перетекают из области высокого потенциала в область низкого потенциала подобно тому, как вода падает водопадом или течет по наклонной плоскости. Причина та же: вода и электроны могут таким образом понизить свою энергию. Теперь внешний источник напряжения действует как две большие реки, соединенные с водопадами: одна на большой высоте, которая ведет к водопаду — это будет отрицательный полюс, а другая на низкой высоте, которая уводит от водопада — это будет плюс.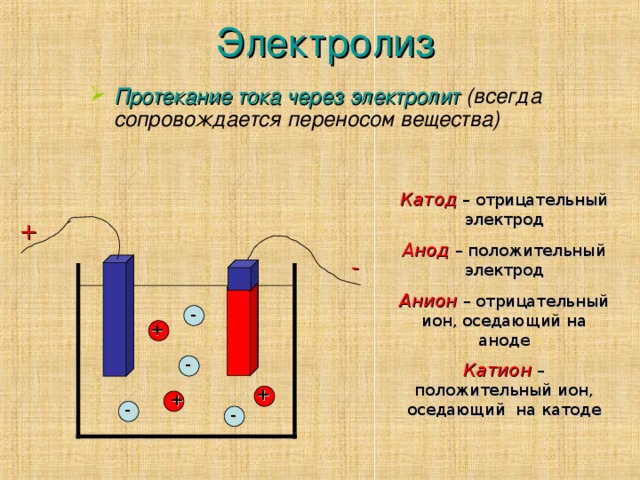 полюс. Электроды будут похожи на точки реки незадолго до или после водопадов на этой картинке: катод подобен краю водопада, где вода падает, а анод — точке, куда вода падает.
полюс. Электроды будут похожи на точки реки незадолго до или после водопадов на этой картинке: катод подобен краю водопада, где вода падает, а анод — точке, куда вода падает.
Хорошо, что происходит при реакции электролиза? На катоде у вас есть ситуация на большой высоте. Так электроны текут к «краю своего водопада». Они хотят «упасть», потому что за их спиной река тянется к краю, оказывая какое-то «давление». Но куда они могут упасть? Другой электрод отделен от них раствором и обычно диафрагмой. Но есть молекулы $\ce{Ox}$ с пустыми состояниями, которые энергетически ниже состояния электрода. Эти пустые состояния подобны небольшим прудам, лежащим на более низкой высоте, куда может упасть немного воды из реки. Таким образом, каждый раз, когда такая молекула $\ce{Ox}$ приближается к электроду, электрон пользуется возможностью прыгнуть к ней и превратить ее в $\ce{Red}$. Но это не означает, что электроду внезапно не хватает одного электрона, потому что река немедленно заменяет «вытолкнутый» электрон.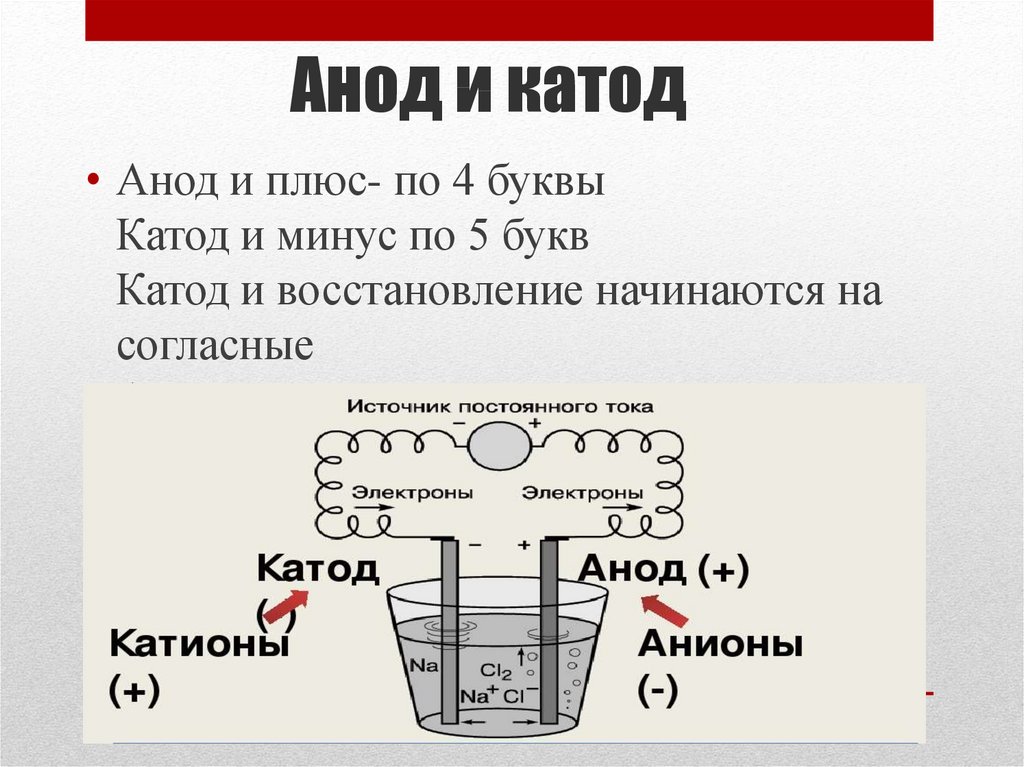 И источник напряжения (источник реки) не может исчерпать электроны, потому что он получает свои электроны из розетки.
И источник напряжения (источник реки) не может исчерпать электроны, потому что он получает свои электроны из розетки.
Теперь анод: На аноде у вас ситуация с малой высотой. Так что здесь река лежит ниже всего остального. Теперь вы можете представить ВЗМО-состояния молекул $\ce{Red}$ в виде небольших барьерных озер, лежащих на большей высоте, чем наша река. Когда молекула $\ce{Red}$ приближается к электроду, это как будто кто-то открывает шлюз плотины барьерного озера. Электроны перетекают из ВЗМО в электрод, создавая молекулу $\ce{Ox}$. Но электроны не остаются, так сказать, в электроде, их уносит река. И поскольку река представляет собой такое обширное образование (много воды) и обычно впадает в океан, добавление небольшого количества «воды» не сильно меняет реку. Он остается прежним, неизменным, так что каждый раз, когда открывается шлюз, вода из барьерного озера падает на одно и то же расстояние.
$\endgroup$
9
$\begingroup$
Электрод, на котором происходит окисление, называется анодом, а электрод, на котором происходит восстановление, называется катодом. -} $, а в 9- \длинная правая стрелка\; Бык }$.
-} $, а в 9- \длинная правая стрелка\; Бык }$.
Реакции восстановления и окисления всегда связаны друг с другом, поэтому один электрод действует как источник электронов, а другой — как приемник. В гальваническом элементе общая реакция протекает самопроизвольно, и ток течет от анода к катоду. С другой стороны, в электролитической ячейке мы управляем реакцией неспонтанно, применяя внешний потенциал (например, используя источник питания).
Я думаю, что это изображение должно прояснить работу обоих типов клеток, процессы, происходящие на каждом электроде, и соглашение о знаках.
Хотя он иллюстрирует специфическую реакцию, вы можете распространить его на другие системы.
Источником изображения является Электролиз I в Chemistry.LibreTexts.
$\endgroup$
0
$\begingroup$
Я не эксперт и не ученый, но из того, что я читаю во всех этих объяснениях, и того, что я замечаю на иллюстрации, становится очевидным. .. по крайней мере, для меня… что, как мне кажется, может прояснить полярность переключение между гальваническим элементом и электролитическим элементом для этого пользователя.
.. по крайней мере, для меня… что, как мне кажется, может прояснить полярность переключение между гальваническим элементом и электролитическим элементом для этого пользователя.
Как установлено и понятно, источник электронов и перенос ионов течет от отрицательного полюса (анод) и принимается положительным полюсом (катодом) (намеренно используя самые основные термины) анод здесь отрицательный, потому что поток исходит ИЗ электролита в лампочку, для которой, если бы клеммы лампочки были помечены, они соответствовали бы электролиту в другой ячейке, так как сила, исходящая от лампочки, толкает поток к катоду ячейки, и катод ячейки вытягивается из колбы.
В электролитической ячейке «электролит» берет на себя роль лампочки гальванической ячейки, так как электроны ПОСЫЛАЮТСЯ К нему из источника питания, и сам по себе не является ИСТОЧНИКОМ потока, но ПОДЛЕЖИТ К силе от источника потока.
ТАК так же, как анод гальванического элемента посылает на лампочку, а электролит помечен как нагрузка гальванического элемента, и передает свою поступающую отрицательную силу от источника тока, и это проталкивает электролит подобно потоку ИЗ лампочка.
Может быть проще, если вы заметите, что ИСТОЧНИК питания НЕ является электролитом и технически черный вывод источника питания является ИСТИННЫМ анодом (Передача), а красная сторона ИСТИННЫМ Катодом (Прием), но при идентификации реактивное вещество погружено/окружено электролитическим веществом, анод отдает свои ионы, которые затем присоединяются к катоду, который их получает.
Поэтому метки в электролитической ячейке указывают не на «источник потока», а на реакцию вовлеченных веществ из-за силы/потока, воздействующей на них от источника питания, но не являющегося источником питания, и поэтому не должен быть маркирован как АС один… и вариантов их маркировки всего два, и так как он не может быть изменен в источнике питания, он может быть изменен только в месте контакта с электролитом!
По крайней мере, это то, что я понял, просмотрев комментарии и иллюстрации.
Я искренне надеюсь, что это поможет прояснить причину смены меток для этого пользователя и любых других, которые борются с концепцией существования из-за того, что источник тока должен быть помечен как — Анод и + Катод . .. заставляя объект ток играет против, несмотря на их полюса и из-за направления потока.
.. заставляя объект ток играет против, несмотря на их полюса и из-за направления потока.
$\endgroup$
$\begingroup$
Знаки (+) и (-) относятся к потоку электронов в источнике питания. В гальваническом (гальваническом) элементе сама ячейка является источником питания. В электролитической ячейке ячейка подключена к внешнему источнику питания. Таким образом, в то время как обозначение анода и катода напрямую связано с направлением потока электронов в ячейке, то, как (+) и (-) относятся к аноду и катоду, зависит от того, идет ли реакция к равновесию или нет (в случае перезаряжаемых батарей, независимо от того, разряжаете вы батарею или заряжаете ее). В зависимости от направления реакции меняются метки анода и катода, а метки (+) и (-) остаются прежними.
Пример иллюстрирует это.
Вот две свинцово-кислотные батареи, соединенные вместе таким образом, что заряженная батарея заряжает разряженную:
Обозначения (+) и (-) относятся к направлению движения электронов, если они разряжаются (конечно, разряженные). аккумулятор дальше разряжаться не может, так что экспериментально не скажешь). Метки анода и катода относятся к конкретной ситуации. Поэтому, если вы подключите источник питания с более высоким напряжением к заряженной батарее вместо разряженной батареи, вы будете заряжать ее дальше. Это обратит химическую реакцию в этой батарее, и метки анода и катода придется поменять местами.
аккумулятор дальше разряжаться не может, так что экспериментально не скажешь). Метки анода и катода относятся к конкретной ситуации. Поэтому, если вы подключите источник питания с более высоким напряжением к заряженной батарее вместо разряженной батареи, вы будете заряжать ее дальше. Это обратит химическую реакцию в этой батарее, и метки анода и катода придется поменять местами.
В другом сценарии вы можете взять две 12-вольтовые батареи и соединить их последовательно (соедините (+) одной с (-) другой). Это даст вам 24-вольтовую батарею, и если вы подключите к ней потребитель, катод будет (+), а анод будет (-) для них обоих.
Для свинцово-кислотных аккумуляторов знаки (+) и (-) никогда не меняются, поэтому можно постоянно маркировать электроды. В концентрационной ячейке (+) и (-) зависят от концентрации окислительно-восстановительных соединений в двух половинных ячейках, поэтому вы не можете пометить их «постоянным маркером».
$\endgroup$
$\begingroup$
Анод – это электрод, на котором протекает полуреакция окисления.
В гальваническом элементе реакция идет самопроизвольно, внешний потенциал не приложен, и когда материал анода окисляется, анод становится отрицательным электродом. В электролитической ячейке именно внешний потенциал запускает реакцию, анод — это электрод, на котором происходит реакция окисления, следовательно, на этот раз это электрод с положительным потенциалом.
$\endgroup$
1
$\begingroup$
Я просто добавляю хороший мнемонический инструмент, как запомнить соглашение об именах:
Анод = анабазис (от греческого ana = «вверх», bainein = «шагать или маршировать»), электроны будут двигаться вверх от электрод к проволоке = окисление .
Ксенофонт, Анабасис, «Марш вверх по стране»
Катод = катабазис (путешествие вниз), электроны будут двигаться вниз от провода к электроду = восстановление
Термины анабазис/катабазис применяются и в других областях.
 Поэтому их называют химическими источниками тока.
Поэтому их называют химическими источниками тока.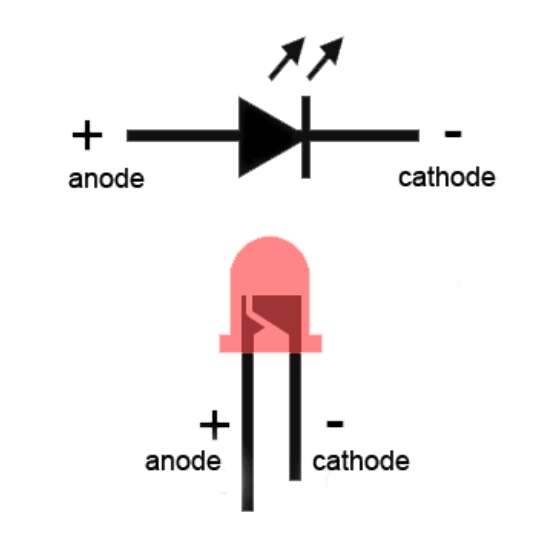 Электрод, на котором происходит окислительная реакция – называется восстановителем.
Электрод, на котором происходит окислительная реакция – называется восстановителем.
 1).
1).